导读
信使RNA(messenger RNA, mRNA)是遗传信息的中间体和生物表达蛋白质的模板,可以将外源mRNA引入靶细胞表达目的蛋白。已上市成功案例表明,RNA疫苗研发周期短,能快速开发新型候选疫苗应对病毒变异,诱导体液免疫及T细胞免疫双重机制,免疫原性强,不需要佐剂且易于批量生产,支持全球性的供应。此外,以mRNA为基础的疫苗、药物开发的优势在于:
▶ 更广泛的应用:mRNA不需要进入细胞核就可以在细胞质内表达蛋白质实现其功能,可以在缓慢分裂或不分裂的细胞中发挥作用,极大地丰富了mRNA的应用场景。
▶ 更高的安全性:由于其表达的瞬时性和基因组整合极低的可能性, 降低了与基因疫苗、药物相关的两个主要风险(宿主基因组的整合和关键区域的突变)。
▶ 可控的药效与药代:体外合成mRNA的半衰期和表达丰度可以通过结构和组分设计来确定,使得mRNA类疫苗药物的药代动力学(pharmacokinetics, PK)被更好地控制。
这些优势为mRNA类疫苗、药物的药品生产质量管理规范(GMP)创造了有利条件。此外,利用细胞自然机制表达的蛋白具有天然的翻译后修饰和适宜的蛋白质折叠效果,这比体外合成的重组蛋白更有优势。近年来,mRNA作为一种治疗手段,在基因治疗领域日益受到重视。体外转录mRNA已应用于临床前及临床试验,包括疫苗研发、癌症治疗和蛋白替代药物等。

以mRNA为代表的疫苗凭借自身特点,迅速改变疫苗行业的格局,为生物制药领域开启了一个全新的赛道。随着mRNA疫苗产能扩大,原料需求猛增,全球针对疫苗高度专业化的生产原料的争夺愈发激烈。
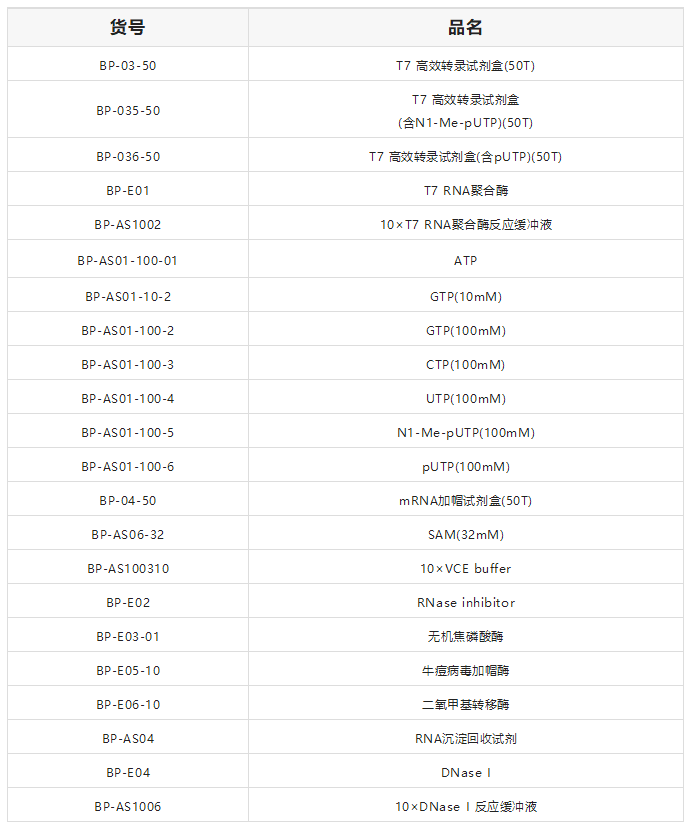
宝锐生物积极布局生物制药领域mRNA疫苗原料酶的开发,依托完善的研发平台和开发经验,秉承对产品一贯的高品质要求,现已开发出T7RNA聚合酶、牛痘病毒加帽酶、二氧甲基转移酶、mRNA加尾酶、无机焦磷酸酶、RNA酶抑制剂等mRNA疫苗生产核心原料酶系列产品,助力国内mRNA产业化进程。


T7RNA聚合酶具有高度启动子专一性,宝锐生物通过基因改造成功开发出针对T7启动子的T7RNA聚合酶,其无论是在纯度还是酶活上,相较竞品都具有明显优势。

图1 高纯度的T7RNA聚合酶
配合宝锐精心优化的转录反应buffer,T7RNA聚合酶能够以含有T7启动子序列的DNA为模板,精准高效识别T7启动子区域(5'-TAATACGACTCACTATAG-3'),从此区域的G开始,利用底物NTPs将后序的DNA序列高效、稳定地转录成单链RNA。

图2 宝锐生物T7高效转录试剂盒

通过大肠杆菌发酵生产的无机焦磷酸酶能催化无机焦磷酸盐水解生成正磷酸盐。在核酸扩增实验中,避免其副产物焦磷酸盐对反应体系的抑制,提高反应动力,在体外转录反应中能提高RNA的产量。此外,针对转录过程中可能存在的RNA酶污染,宝锐生物的RNase inhibitor能与RNase以非共价键结合形成复合体,抑制多种类型RNase,有效保护RNA不被降解。



依托于完善的mRNA合成酶原料系列产品,宝锐生物开发了针对不同模板、不同核苷酸类型优化后的T7高效转录试剂盒(货号:BP-03-50)。该试剂盒通过短时间的体外转录,能够一次性得到大量RNA,1μg的模板投入量可获得约160μg至200μg的产物。
此外,在反应底物中添加Cap0或者Cap1等帽结构或帽结构类似物,也可通过该试剂盒转录产生具有帽子结构的mRNA。

图4 宝锐生物T7高效转录试剂盒
转录产量与国外竞品一致,优于国内竞品
大量来自内部与客户的工艺验证表明,宝锐生物所生产的T7高效转录试剂盒转录产量在市场同类产品中有明显优势,其产物纯度无论通过电泳还是HPLC检验,都处于较高的水平。

图5 宝锐生物高效转录试剂盒
转录产物琼脂糖电泳图
注:M:ssRNA ladder 6000
1:T7高效转录试剂盒转录产物一
2:T7高效转录试剂盒转录产物二
3:T7高效转录试剂盒转录产物(含pUTP)
4:T7高效转录试剂盒转录产物(含N1-Me-pUTP)

图6 HPLC显示宝锐生物T7高效转录试剂盒
在mRNA生产过程中,dsRNA的残留是亟待解决的问题,宝锐生物通过大量的工艺优化与配方筛选产出的T7高效转录试剂盒,能一定程度上抑制dsRNA的产出,从源头上控制dsRNA残留量。数据显示,使用宝锐生物T7高效转录试剂盒所生产的mRNA,其dsRNA含量与竞品对比,处于较低水平。

转录产物dsRNA含量低于竞品

成熟mRNA 5'端的帽子结构,即m7GPPPN结构,又称为甲基鸟苷帽子,帽子结构不仅可以保护mRNA不被RNase切割,延长半衰期;还能提高mRNA在翻译、剪接以及从细胞核导出等环节中的稳定性。
宝锐生物推出的牛痘病毒加帽酶(VCE,Vaccinia caping enzyme)整合了mRNA三磷酸酯酶、鸟苷酰基转移酶和鸟嘌呤甲基转移酶等加帽酶必要活性,S-腺苷甲硫氨酸(SAM)作为甲基供体,可直接将m7G帽结构加到mRNA的5'端;该结构与mRNA的稳定、转运和翻译密切相关,能显著改善用于细胞验证和体内表达的mRNA的稳定性和翻译能力。
宝锐生物同时推出二氧甲基转移酶(2'O-methyltransferase),以具有Cap0结构的RNA为底物,利用S-腺苷甲硫氨酸(SAM),Cap0结构被修饰成Cap1,能进⼀步降低mRNA本⾝的免疫原性,提⾼其转染后编码蛋⽩的表达⽔平。

二氧甲基转移酶加帽后GFP表达情况

在mRNA的生产过程中,利用质粒模板携带Poly(A)序列转录出带poly(A)尾的mRNA是首.选,针对特殊工艺,可能需要采用转录后加尾的方式。
根据此使用场景,宝锐生物推出不依赖模板的mRNA加尾酶,能够催化ATP以AMP的形式依次掺入到RNA的3'末端,即在RNA的3'末端加多聚A尾。该酶具有很高的加尾效率,通过控制该酶的使用量,可以在RNA的3'末端稳定地加入20-200个A碱基的不同长度poly(A)尾,增加mRNA的稳定性及翻译的效率。

图9 通过控制酶量能稳定形成
不同poly(A)尾长的产物

附:mRNA应用发展历程
mRNA的应用并不是一个很新的领域。自1978年Dimitriadis教授首次将脂质体包裹的mRNA递送进细胞以来的40年间,mRNA技术的发展离不开数百位研究人员的辛勤付出,这些研究为今天mRNA的大规模应用奠定了坚实的基础。
修饰核苷酸的应用,有效降低了mRNA强烈的免疫原性,使体外合成的mRNA在体内能够避免免疫系统清除;加帽酶和帽类似物的发展,为我们在体外制备与体内结构相似的mRNA,提供了丰富的选择;日新月异的脂质递送技术不断发展,终于在今天取得了应用。这些大量的基础性研究工作的突破以及各种技术的更迭,极大推动了mRNA应用领域的发展。

